Diferencia entre revisiones de «El papel de las lombrices de tierra en la descomposición de la materia orgánica y el ciclo de nutrientes»
| Línea 2: | Línea 2: | ||
Tomado de: https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/61/58 | Tomado de: https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/61/58 | ||
| + | |||
| + | |||
| + | [[Archivo:M. Aira AV..jpg|200px]] | ||
| + | |||
| + | M. Aira. | ||
| + | Es investigador del Departamento de Ecología y Biología Animal de la Universidad de Vigo. Posee un doctorado y tiene más de 94 publicaciones como autor o coautor. Es experto en fertilidad y análisis del suelo, así como agricultura sostenible. | ||
Revisión del 02:13 2 ago 2024
Autores: J. Domínguez, M. Aira y M. Gómez-Brandón
Tomado de: https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/61/58
M. Aira. Es investigador del Departamento de Ecología y Biología Animal de la Universidad de Vigo. Posee un doctorado y tiene más de 94 publicaciones como autor o coautor. Es experto en fertilidad y análisis del suelo, así como agricultura sostenible.
RESUMEN
Las lombrices de tierra representan la mayor biomasa animal en la mayoría de ecosistemas templados terrestres, y allí donde son abundantes pueden procesar a través de sus cuerpos hasta 250 toneladas del suelo al año por hectárea. Este inmenso trabajo influye de forma muy significativa en las propiedades físicas, químicas y biológicas del suelo, y otorga a estos organismos un papel crucial en la modificación de la estructura del suelo, en la aceleración de la descomposición de la materia orgánica y del reciclado de nutrientes, que tiene a su vez efectos muy importantes sobre las comunidades vegetales que viven por encima de la superficie del suelo. En este trabajo hemos querido revisar e ilustrar cómo las lombrices de tierra son verdaderos aceleradores de los procesos de descomposición de la materia orgánica y del reciclado de nutrientes a través de sus relaciones con las comunidades microbianas del suelo.
Lombrices de tierra
Las lombrices de tierra son anélidos oligoquetos clitelados macroscópicos que viven en el suelo. Estos invertebrados representan la mayor biomasa animal en la mayoría de ecosistemas templados terrestres, influyen de forma muy significativa en las propiedades físicas, químicas y biológicas del suelo, y juegan un papel crucial en la modificación de la estructura del suelo y en la aceleración de la descomposición de la materia orgánica y del reciclado de nutrientes (Edwards y Bohlen 1996; Lavelle y Spain 2001; Domínguez et al. 2004). Se han descrito más de 8000 especies de lombrices de tierra, aunque de la gran mayoría sólo se conoce el nombre y su morfología, y se desconoce su biología y ecología. Las distintas especies de lombrices tienen estrategias vitales diferentes, ocupan nichos ecológicos distintos y se han clasificado, sobre la base de su alimentación y de la zona del suelo en la que viven, en tres categorías ecológicas: epigeas, anécicas y endogeas (Bouché 1977). Las especies epigeas viven en el horizonte orgánico, en o cerca de la superficie del suelo, alimentándose principalmente de materia orgánica en descomposición (restos vegetales, heces de animales, etc.). Suelen ser especies de pequeño tamaño, pigmentadas y con altas tasas metabólicas y reproductivas que les permiten adaptarse a las condiciones ambientales tan variables de la superficie del suelo. Producen deyecciones holorgánicas (Fig. 1) y presentan una tasa alta de consumo, digestión y asimilación de la materia orgánica, por lo que juegan un papel clave como transformadoras del mantillo.
Las especies endogeas viven a mayor profundidad en el perfil del suelo, y se alimentan principalmente de suelo y de la materia orgánica asociada. Tienen poca pigmentación, y construyen sistemas de galerías horizontales muy ramificadas, que llenan con sus propias deyecciones mientras se mueven por el horizonte orgánico-mineral del suelo. A diferencia de las lombrices epigeas, las especies endogeas presentan tasas de reproducción más bajas y ciclos de vida más largos, y son más resistentes a períodos de ausencia de alimento. Las especies anécicas viven de forma más o menos permanente en galerías verticales, que pueden extenderse varios metros hacia el interior del perfil del suelo. Por las noches emergen a la superficie para alimentarse de hojarasca, heces y materia orgánica en descomposición, que transportan al fondo de sus galerías; depositan sus excrementos en la superficie. Normalmente estas lombrices son grandes y de color pardo oscuro. Sus tasas reproductivas son relativamente bajas (Bouché 1977; Lavelle et al. 1997; Lavelle and Spain 2001; Monroy et al. 2007).
Red trófica del suelo
El suelo sostiene una red trófica muy compleja cuyo funcionamiento resulta en último término en el reciclaje de la materia orgánica y el ciclo de nutrientes. Los consumidores primarios de esta red trófica son los microorganismos (bacterias y hongos) que descomponen y mineralizan sustancias orgánicas complejas (ver Gallardo et al. 2009) . Los microbios son con muchísima diferencia los miembros más abundantes y diversos de esta red trófica, y así por ejemplo en un gramo de suelo puede haber entre 5000 y 10000 especies de microorganismos (Torsvik et al. 2002). Los consumidores secundarios y de niveles superiores son los protozoos y muchos animales de tamaño variado que cohabitan con los microbios, alimentándose de ellos y dispersándolos a través del suelo. La manera más simple de clasificar a los animales del suelo es hacerlo en función del tamaño de su cuerpo. La microfauna incluye a los invertebrados más pequeños (ancho del cuerpo < 0,2 mm), fundamentalmente nematodos y la mayoría de los ácaros, que o bien ingieren microorganismos o metabolitos microbianos o forman parte de redes tróficas de microdepredadores. La mesofauna (invertebrados de tamaño medio, con una anchura corporal entre 0,2 y 10 mm) es muy diversa taxonómicamente (incluyendo muchos anélidos, insectos, crustáceos, miriápodos, arácnidos y otros artrópodos) que funcionan como transformadores del mantillo vegetal, e ingieren una mezcla de materia orgánica y microorganismos. Además de digerir parte de este material generan importantes cantidades de heces que sufrirán un ataque microbiano posterior debido a las condiciones favorables de humedad y al mezclado intenso que tuvo lugar durante su paso a través del intestino. Posteriormente, otros invertebrados pueden reingerir estas deyecciones (coprofagia) y asimilar una nueva serie de sustratos que han quedado disponibles como consecuencia de la reciente actividad microbiana. En ocasiones estos depósitos fecales pueden acumularse y llegar a formar el horizonte H de algunos tipos de humus. Por último la macrofauna, formada por los invertebrados más grandes (ancho corporal > 1 cm), incluye fundamentalmente a las lombrices de tierra, junto con algunos moluscos, miriápodos y distintos grupos de insectos.
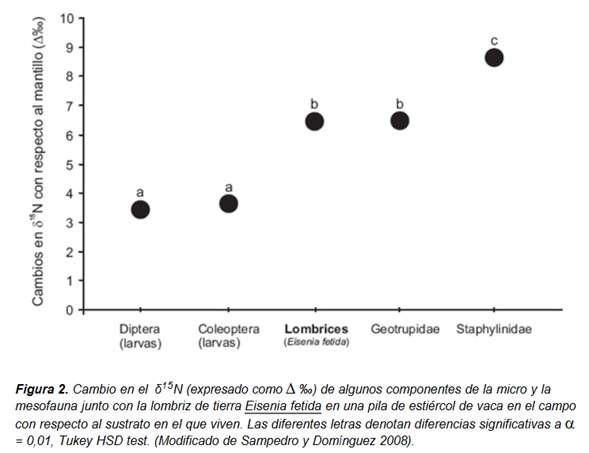
Todos estos organismos ocupan varios niveles tróficos, de forma que algunos se alimentan fundamentalmente de microbios (microbívoros), otros de materia orgánica en descomposición (detritívoros), otros de una mezcla de materia orgánica y microbios (microbi-detritívoros), mientras que otros son carnívoros o pueden ocupar varios niveles tróficos (Sampedro y Domínguez 2008). Algunos autores han propuesto que en las redes tróficas detríticas existe un rango continuo de estrategias de alimentación que va desde la microbivoría pura hasta la detritivoría pura (Scheu 2002), aunque su estructura trófica y la utilización específica de los recursos en ellas todavía no se conocen bien. Por ejemplo, todavía no sabemos con certeza dónde obtienen la energía las lombrices (materia orgánica en descomposición, microorganismos, microfauna o una combinación de todos ellos). Las lombrices pueden utilizar diferentes estrategias de alimentación, desde mecanismos no selectivos en los que engullirían todo el suelo hasta estrategias selectivas de apacentamiento (grazing), y parece que tienen la capacidad de obtener energía tanto de fuentes de carbono vivas como muertas (Domínguez et al. 2003; Aira et al. 2008).
Por otra parte, las interacciones bióticas entre los descomponedores y la fauna del suelo incluyen procesos de competencia, mutualismo, depredación, y facilitación (esta última, quizás menos conocida, es una relación entre individuos de especies diferentes dentro de un ecosistema donde alguna de las especies se beneficia de vivir y crecer junto a otra).
Las lombrices de tierra y la descomposición de la materia orgánica
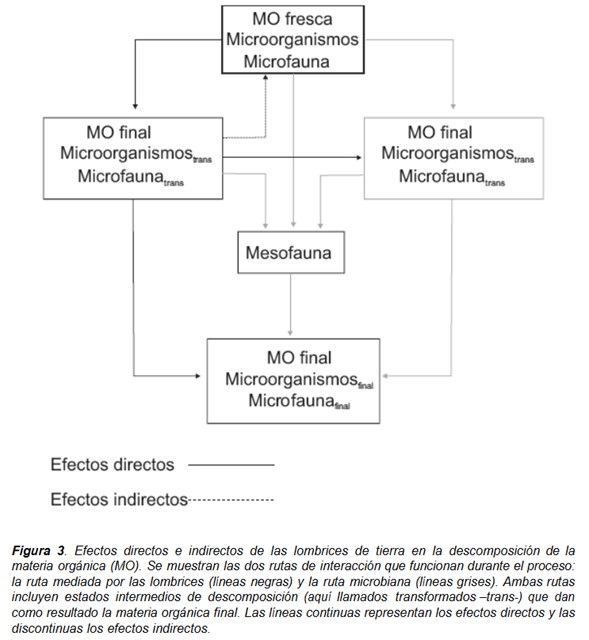
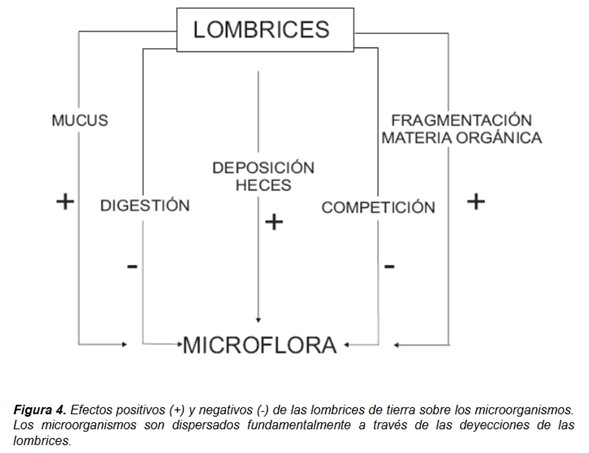
La descomposición es un proceso en cascada en el que la materia orgánica muerta experimenta una sucesión de transformaciones físicas y químicas en el suelo que conducen a la mineralización de una parte del recurso y al depósito de compuestos resistentes en forma de humus (Swift et al. 1979). Los microorganismos producen las enzimas responsables de la descomposición bioquímica de la materia orgánica, pero donde son abundantes, las lombrices son elementos clave del proceso e influyen en él a través de efectos directos e indirectos (Fig. 3). Las lombrices de tierra modifican la biomasa microbiana y su actividad de forma directa a través de la estimulación, digestión y dispersión de los microorganismos (Fig. 4) e interaccionan con otros componentes biológicos del sistema del suelo, afectando en consecuencia a la estructura de las comunidades de la microflora y de la microfauna (Fig. 3) (Domínguez et al. 2003; Lores et al. 2006). Los efectos indirectos derivan de los directos e incluyen procesos de envejecimiento y mezclado de materiales modificados por las lombrices con otros sustratos orgánicos no modificados por ellas (Fig. 3). Como consecuencia de toda esta cascada de procesos, la materia orgánica del suelo conforma una matriz espacial y temporalmente heterogénea con características diferentes resultantes de las distintas tasas de degradación que tienen lugar durante la descomposición (Moore et al. 2004).
La descomposición de la materia orgánica incluye dos fases diferentes en relación a la actividad de las lombrices de tierra, (i) una fase activa o directa, durante la cual las lombrices procesan la materia orgánica, modificando sus propiedades físicas y su composición microbiana (Lores et al. 2006), y (ii) una fase de maduración o indirecta durante la que los microbios asumen el control de la descomposición del material previamente procesado por las lombrices (Domínguez 2004). La duración de la fase activa no es fija, y depende de la especie y de la densidad de lombrices, así como de sus tasas de ingestión y procesado de materia orgánica (Aira y Domínguez 2008).
Las lombrices participan en la descomposición de la materia orgánica a través, en primer lugar, de los procesos asociados al paso a través de sus intestinos (PAIs), que incluyen todas las modificaciones que la materia orgánica en descomposición y los microorganismos sufren durante ese tránsito (Fig. 5). Estas modificaciones incluyen la reducción del tamaño de partícula tras el paso por la molleja, la adición de azúcares y otras sustancias, la modificación de la actividad y de la diversidad microbiana, la modificación de las poblaciones de la microfauna, la homogeneización del sustrato y los procesos intrínsecos de digestión y asimilación; incluyen también la producción de moco y sustancias excretoras como la urea y el amonio, que constituyen una fuente de nutrientes fácilmente asimilables para los microorganismos. La descomposición se ve también favorecida por la acción de microorganismos endosimbiontes que viven en el intestino de las lombrices. Estos microbios producen enzimas extracelulares que degradan celulosa y distintos compuestos fenólicos, aumentando la degradación del material ingerido. Otras modificaciones físicas del sustrato originadas por las actividades excavadoras de las lombrices, como la aireación y la homogeneización del sustrato, también favorecen la actividad microbiana y por consiguiente la descomposición de la materia orgánica (Domínguez 2004). La actividad directa de las lombrices aumenta significativamente la mineralización del carbono y nitrógeno en el sustrato, y tales efectos son proporcionales a la densidad de lombrices (Aira et al. 2008). Otros autores han encontrado respuestas similares en organismos detritívoros involucrados en la descomposición de la materia orgánica (Aira et al. 2002; Vetter et al. 2004).
Una vez finalizados los procesos asociados al intestino (PAIs) las deyecciones de las lombrices, es decir los materiales excretados por las mismas sufrirán los procesos asociados a las deyecciones (PADs), más relacionados con procesos de envejecimiento, con la acción de la microflora y la microfauna presente en el sustrato y con la modificación física de los materiales excretados (Fig. 4); estos procesos pueden variar en duración de semanas a meses (Aira et al. 2005). Durante estos procesos los efectos de las lombrices son indirectos y derivados de los procesos asociados al intestino (PAIs).
Estimulación y aceleración de la descomposición por la acción de las lombrices de tierra
La mineralización de nutrientes está gobernada directamente por las actividades de las bacterias y de los hongos. Pero estas actividades están muy influenciadas por la fauna del suelo que vive junto a los microorganismos, y también por distintas interacciones de la red trófica que determinan la transferencia de nutrientes a través del sistema. En este sentido, las deyecciones de las lombrices de tierra juegan un papel muy importante en la descomposición porque contienen nutrientes y microorganismos que son diferentes a los contenidos en el material orgánico antes de la ingestión (Brown y Doube 2004; Aira et al. 2006b; Aira y Domínguez 2009). Esto permite una mejor explotación de los recursos remanentes ya sea por la aparición de nuevas especies de microbios en los sustratos frescos a procesar o por la misma presencia de un conjunto de compuestos más fácilmente asimilables en las deyecciones.
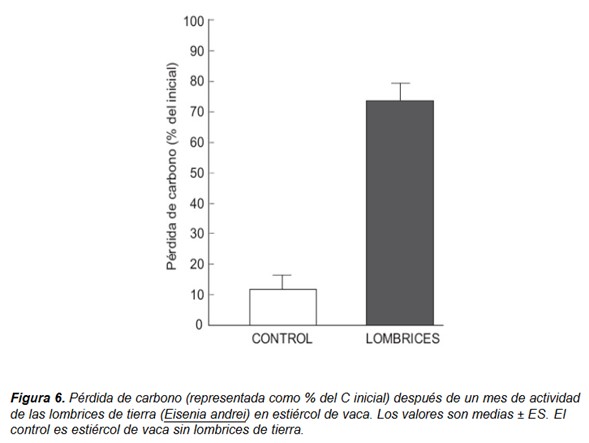
Existen claras evidencias de que las lombrices de tierra aceleran la tasa de descomposición de la materia orgánica (Fig. 6) (Atiyeh et al. 2000; Domínguez et al. 2003; Domínguez 2004; Aira y Domínguez 2008, 2009; Aira et al. 2006a, 2007a, 2007b, 2008). Aunque las lombrices pueden asimilar carbono de las fracciones más lábiles de los restos orgánicos, su contribución a la respiración heterotrófica total es muy pequeña debido a su baja capacidad de asimilación.
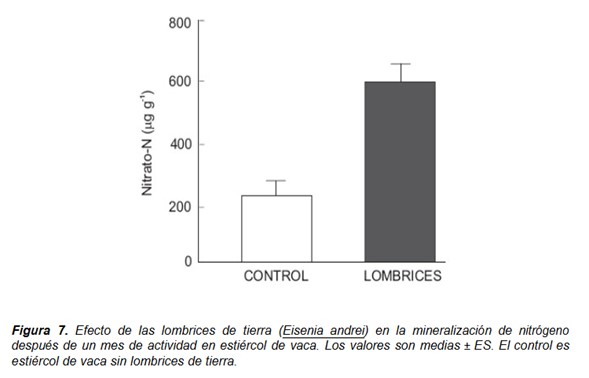
La mineralización de nitrógeno está regulada básicamente por la disponibilidad de nitrógeno orgánico disuelto y amonio, la actividad de los microorganismos y sus requisitos relativos de carbono y nitrógeno. Las lombrices de tierra también tienen un gran impacto en las transformaciones del nitrógeno a través de modificaciones de las condiciones ambientales y de sus interacciones con los microorganismos; así su actividad en los restos orgánicos produce condiciones que favorecen la nitrificación, que resulta en la conversión rápida del nitrógeno amoniacal en nitratos, aumentando la mineralización de nitrógeno (Fig. 7) (Atiyeh et al. 2000; Domínguez 2004; Lazcano et al. 2008; Aira et al. 2008; Aira y Domínguez 2009).
Aunque ya habíamos comentado que todavía no está claro el nivel trófico que ocupan las lombrices de tierra, es muy probable que combinen hábitos detritívoros y microbívoros. En este sentido, los efectos de la fauna microbívora sobre la actividad microbiana y la mineralización de nutrientes son generalmente positivos. La estimulación de la mineralización del carbono se debe al aumento de la actividad de las poblaciones microbianas y de la tasa de reposición de las poblaciones microbianas consumidas, mientras que el aumento de la mineralización de N se debe fundamentalmente a la excreción directa del exceso de N. En general, los microbívoros tienen eficiencias de asimilación más bajas que los microbios sobre los que “pastan”, y por eso excretan los nutrientes excedentes en formas biológicamente disponibles (así por ejemplo los protozoos bacterívoros liberan alrededor de un tercio del N consumido (Bardgett 2005)). Esta liberación de nutrientes constituye de hecho una removilización de aquellos nutrientes que estaban secuestrados en la biomasa microbiana, y se conoce como “bucle microbiano” (Clarholm 1994).
Efectos de las lombrices de tierra en la estructura de las comunidades microbianas
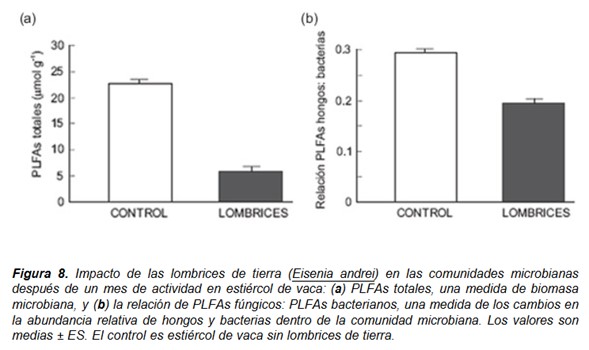
Las técnicas de análisis de los ácidos grasos de los fosfolípidos (PLFAs, phospholipid fatty acids) (Zelles 1999) han revelado que las lombrices tienen un gran impacto en la estructura y en la función de las comunidades microbianas. En este sentido, experimentos realizados por los autores han mostrado que la presencia y la actividad de las lombrices reduce hasta cuatro o cinco veces la biomasa microbiana viable de la materia orgánica en descomposición, medida como el contenido total de ácidos grasos de los fosfolípidos (PLFAs), después un mes de actividad en comparación al control sin lombrices (Fig. 8a). La actividad de las lombrices también redujo la proporción de PLFAs de hongos / PLFAs de bacterias (Fig. 8b) lo que indica que la disminución de PLFAs fúngicos fue proporcionalmente mayor que la de PLFAs bacterianos.
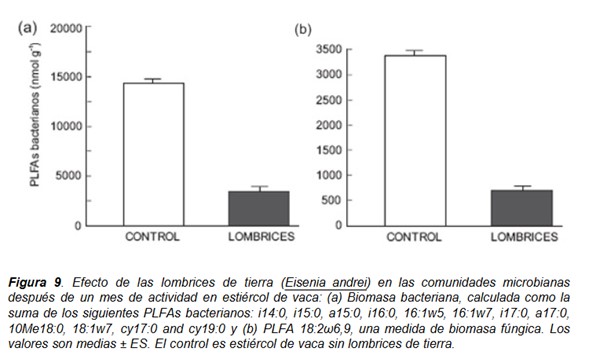
Algunos de estos PLFAs específicos se pueden utilizar como biomarcadores para determinar el efecto de las lombrices en la presencia y la abundancia de determinados grupos microbianos; así hemos escogido la suma de los PLFAs característicos de bacterias Gram-positivas (PLFAs ramificados iso y anteiso), bacterias Gram-negativas (PLFAs monoinsaturados y con grupos ciclopropil) y de actinomicetos (PLFAs ramificados 10Me) para representar la biomasa bacteriana; y el biomarcador fúngico 18:2ω6,9 para determinar la biomasa fúngica (Frostegård y Bååth 1996; Zelles 1997). Encontramos que la abundancia tanto de bacterias como de hongos se vio drásticamente disminuida por la acción de las lombrices después de un mes de actividad (Fig. 9). Las lombrices pueden reducir la biomasa microbiana directamente mediante consumo selectivo de bacterias y hongos (Schönholzer et al. 1999) o indirectamente acelerando drásticamente la reducción de recursos para los microbios.
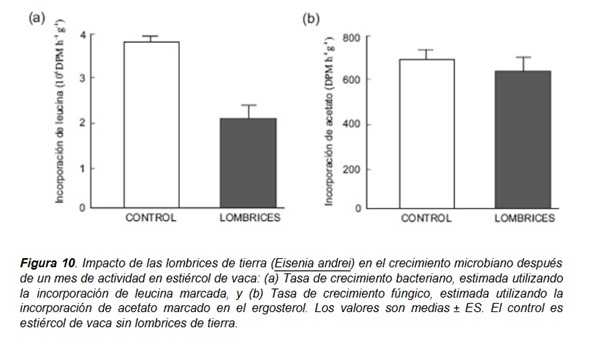
En los mismos experimentos estimamos las tasas de crecimiento bacteriano mediante la incorporación de [metil-3H]-leucina (Leu) según el método de microcentrifugación (Bååth et al. 2001) y el crecimiento fúngico midiendo la incorporación de [1,2 14C]-acetato en la molécula de ergosterol ((Bååth 2001). Encontramos que la actividad de las lombrices produjo una gran disminución de la tasa de crecimiento bacteriana y no afectó a la tasa de crecimiento fúngico después de un mes de actividad (Fig. 10). Los estiércoles animales son ambientes ricos en microorganismos en los que las bacterias constituyen la fracción más grande, con los hongos presentes principalmente en forma de esporas; además, las primeras fases de la descomposición en estos residuos orgánicos están dominadas primordialmente por las bacterias debido a la disponibilidad de agua y sustratos fácilmente descomponibles. Por lo tanto, es esperable que la actividad de las lombrices afecte a la tasa de crecimiento bacteriano en mayor grado que al crecimiento fúngico. Además, la disponibilidad de carbón es un factor limitante para el crecimiento de las lombrices y se ha señalado que las lombrices y los microorganismos pueden competir por el carbono (Tiunov y Scheu 2004). La actividad de las lombrices pudo haber reducido la cantidad de recursos disponibles para las comunidades microbianas, y consecuentemente la tasa de crecimiento bacteriano. Sin embargo cabría esperar que la tasa de crecimiento fúngico disminuya posteriormente, durante la etapa de maduración, una vez que los recursos menos recalcitrantes se hubiesen agotado.
Efectos de las lombrices sobre la actividad de las comunidades microbianas
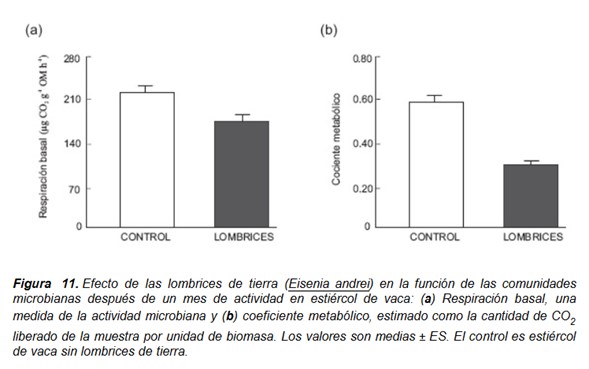
Como se ha discutido en párrafos anteriores, hay bastantes evidencias que sugieren que las lombrices y otros animales microbívoros del suelo aumentan la actividad microbiana en primer término. Como consecuencia, la actividad de las lombrices reduce la disponibilidad de recursos para las comunidades microbianas, y posteriormente y de forma consecuente su actividad. Así encontramos que la actividad microbiana medida como respiración basal disminuyó después de un mes de actividad de las lombrices (Fig. 11a).
El carbono orgánico consumido por las comunidades microbianas heterótrofas se reparte entre la producción de biomasa microbiana, la excreción de metabolitos y la respiración. La proporción de carbono del sustrato retenido como biomasa microbiana en relación al carbono respirado como CO depende de la eficiencia del crecimiento microbiano (es decir, la eficiencia con la que los sustratos son incorporados como biomasa bacteriana y fúngica o transformados en subproductos),
así como del grado de protección de la biomasa microbiana en el suelo y de la tasa de descomposición de los subproductos bacterianos y fúngicos por otros microorganismos. Cuanto más baja sea la eficiencia de crecimiento microbiana o menos protegida esté la biomasa, mayor será la cantidad de carbono perdido como CO . Así, el cociente metabólico o actividad específica de la biomasa microbiana (qCO ; respiración microbiana por unidad de biomasa) se puede usar como una medida de eficiencia microbiana, de forma que valores más altos de qCO indican que las comunidades microbianas están bajo condiciones de mayor estrés, y que destinarán menos energía metabólica a procesos de biosíntesis, mientras que se gastará una porción importante en el mantenimiento de las células (que se perderá como CO ). En este caso nos encontramos con que la actividad de las lombrices redujo el cociente metabólico después un mes de actividad (Fig. 11b), lo que indica que las comunidades microbianas utilizaron la energía disponible más eficazmente en presencia de lombrices. Como consecuencia, el sistema funciona mucho mejor, como se muestra por el incremento abrumador en la tasa de descomposición de materia orgánica (Fig. 6) y en la tasa de mineralización de nitrógeno (Fig. 7).
Agradecimientos
Este trabajo ha sido financiado con fondos FEDER y los proyectos CGL2006-11928/BOS del Ministerio de Educación y Ciencia y 07MRU023383PR de la Xunta de Galicia.
Referencias
Aira, M., Monroy, F., Domínguez, J., Mato, S. 2002. How earthworm density affects microbial biomass and activity in pig manure. European Journal of Soil Biology 38:7-10.
Aira, M., Monroy, F., Domínguez, J. 2005. Ageing effects on nitrogen dynamics and enzyme activities in casts of Aporrectodea caliginosa (Lumbricidae). Pedobiologia 49:467-473.
Aira, M., Monroy, F., Domínguez, J. 2006a. Changes in microbial biomass and microbial activity of pig slurry after the transit through the gut of the earthworm Eudrilus eugeniae. Biology and Fertility of Soils 42:371-376.
Aira, M., Monroy, F., Domínguez, J. 2006b. Eisenia fetida (Oligochaeta, Lumbricidae) activates fungal growth, triggering cellulose decomposition during vermicomposting. Microbial Ecology. 52:738-746.
Aira, M., Monroy, F., Domínguez, J. 2007a. Eisenia fetida modifies the structure of microbial communities improving carbon mineralization during vermicomposting of pig manure. Microbial Ecology 54:662-671.
Aira, M., Monroy, F., Domínguez, J. 2007b. Earthworms strongly modify microbial biomass and activity triggering enzymatic activities during vermicomposting. Science of the Total Environment 385:252-261.
Aira, M., Sampedro, L., Monroy, F., Domínguez, J. 2008. Detritivorous earthworms directly modify the structure, thus altering the functioning of a microdecomposer food web. Soil Biology and Biochemistry 40:2511-2516.
Aira, M., Domínguez, J. 2008. Optimizing vermicomposting of animal wastes: effects of dose of manure application on carbon loss and microbial stabilization. Journal of Environmental Management 88:1525-1529.
Aira, M., Domínguez, J. 2009. Microbial and nutrient stabilization of two animal manures after the transit through the gut of the earthworm Eisenia fetida. Journal of Hazardous Materials 161:1234-1238.
Atiyeh, R., Dominguez, J., Subler, S., Edwards, C.A. 2000. Changes in biochemical properties of cow manure during processing by earthworms and the effects on seedling growth. Pedobiologia 44:709-724.
Bååth, E. 2001. Estimation of fungal growth rates in soil using 14C-acetate incorporation into ergosterol. Soil Biology and Biochemistry 33:2011-2018.
Bååth, E., Pettersson, M., Söderberg, K.H. 2001. Adaptation of a rapid and economical microcentrifugation method to measure thymidine and leucine incorporation by soil bacteria. Soil Biology and Biochemistry 33:1571-1574.
Bardgett, R.D. 2005. The biology of soil: a community and ecosystem approach. Oxford University Press, Oxford, UK.
Bouché, M.B. 1977. Strategies lombriciennes. En: Lohm, U. y Persson, T. (eds..) Soil Organisms as Components of Ecosystems, pp. 122-132, Biology Bulletin, Stockholm. Sweden.
Brown, G.G., Doube, B.M. 2004. Functional interactions between earthworms, microorganisms, organic matter, and plants. En: Edwards, C.A. (ed.), Earthworm Ecology, 2nd edn., pp. 213-224, CRC Press, Boca Raton. USA.
Clarholm, M. 1994. The microbial loop. En: Ritz, K., Dighton, J. y Giller, K.E. (eds.), Beyond the Biomass, pp. 355-365, Blackwell Scientific Publications, Oxford UK.
Domínguez, J. 2004. State of the art and new perspectives on vermicomposting research. En: Edwards, C.A. (ed.), Earthworm Ecology, 2nd edn., pp. 401-424, , CRC Press, Boca Raton FL USA.
Domínguez, J., Parmelee, R.W., Edwards, C.A. 2003. Interactions between Eisenia andrei and nematode populations during vermicomposting. Pedobiologia 47:53-60.
Domínguez, J., Bohlen, J.P., Parmelee, R.W. 2004. Earthworms increase nitrogen leaching to greater soil depths in row crop agroecosystems. Ecosystems 7:672-685.
Edwards, C.A., Bohlen, P.J. 1996. Biology and ecology of earthworms. 426 pp. Chapman and Hall, London,
Frostegård, Å., Bååth, E. 1996. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil. Biology and Fertility of Soils 22:59-65.Ecosistemas 18 (2). Mayo 2009.30
Gallardo A., Delgado M., Morillas L. y Covelo, F. 2009. Ciclos de nutrientes y procesos edáficos en los ecosistemas terrestres: especificidades del caso mediterráneo y sus implicaciones para las relaciones suelo-planta. Ecosistemas 18(2):4-19.
Lazcano, C., Gómez-Brandón, M., Domínguez, J. 2008. Comparison of the effectiveness of composting and vermicomposting for the biological stabilization of cattle manure. Chemosphere 72:1013-1019.
Lavelle, P., Bignell, D., Lepage, M., Wolters, V., Roger, P., Ineson, P., Heal, O.W., Ghillion, S. 1997. Soil function in a changing world: the role of invertebrate ecosystem engineers. European Journal of Soil Biology 33:159-193.
Lavelle, P., Spain, A.V. 2001. Soil ecology. Kluwer Academic Publishers, London. UK.
Lores, M., Gómez-Brandón, M., Pérez-Díaz, D., Domínguez, J. 2006. Using FAME profiles for the characterization of animal wastes and vermicomposts. Soil Biology and Biochemistry 38:2993-2996.
Monroy, F., Aira, M., Domínguez, J. 2007. Life cycle of the earthworm Octodrilus complanatus (Oligochaeta, Lumbricidae). Comptes Rendus Biologies 330:389-391.
Moore, J.C., Berlow, E.L., Coleman, D.C., de Ruiter, P.C., Dong, Q., Johnson, N.C., McCann, K.S., Melville, K., Morin, P.J., Nadelhoffer, K., Rosemond, A.D., Post, D.M., Sabo, J.L., Scow, K.M., Vanni, M.J., Wall, D.H. 2004. Detritus, trophic dynamics and biodiversity. Ecology Letters 7:584-600.
Sampedro, L., Domínguez, J. 2008. Stable isotope natural abundances (δ13C and δ15N) of the earthworm Eisenia fetida and other soil fauna living in two different vermicomposting environments. Applied Soil Ecology 38:91-99.
Scheu, S. 2002. The soil food web: structure and perspectives. European Journal of Soil Biology 38:11-20.
Schönholzer, F., Dittmar, H., Zeyer, J. 1999. Origins and fate of fungi and bacteria in the gut of Lumbricus terrestris L. studied by image analysis. FEMS Microbiology Ecology 28:235-248.
Swift, M.J., Heal, O.W., Anderson, J.M. 1979. Decomposition in terrestrial ecosystems. Blackwell Scientific Publications, Oxford. UK.
Tiunov, A.V., Scheu, S. 2004. Carbon availability controls the growth of detritivores (Lumbricidae) and their effect on nitrogen mineralization. Oecologia 138:83-90.
Torsvik, V., Ovreas, L. and Thingstad, T.F. 2002. Prokaryotic diversity: magnitude, dynamics and controlling factors. Science296:1064-1066
Vetter, S., Fox, O., Ekschmitt, K., Wolters, V. 2004. Limitations of faunal effects on soil carbon flow: density dependence, biotic regulation and mutual inhibition. Soil Biology and Biochemistry 36:387-397.
Zelles, L. 1997. Phospholipid fatty acid profiles in selected members for soil microbial communities. Chemosphere 35:275-94.
Zelles, L. 1999. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterization of microbial communities in soil: a review. Biology and Fertility of Soils 29:111-129.
Enfoque didáctico