Procesos metabólicos fuera del delgado aire.
Presentación a Fuera del Delgado Aire
El estudio del microcosmos siempre había sido difícil; principalmente por las limitaciones impuestas por nuestra propia capacidad visual. El desarrollo de instrumentos ópticos que nos permiten acceder a lo pequeño es relativamente reciente: de los simples microscopios ópticos del siglo XVIII, al desarrollo del microscopio electrónico a mediados del siglo pasado y a los modernos microscopios de barrido. Este desarrollo tecnológico, aunado a las modernas técnicas de tinción y elaboración de cortes y fractura por congelación ha abierto un mundo antes insospechado. No cabe duda de que grandes investigadores y difusores del conocimiento científico como Lynn Margulis han puesto sobre la mesa la gran importancia de los microorganismos en todas las facetas del mundo vivo y como agentes capaces de moderar algunos parámetros ambientales.
David W. Wolfe es uno de estos visionarios investigadores, que no solo se limita a estudiar a las bacterias (en este caso a las quimiosintéticas), sino que estudia sus relaciones con las propiedades nutricionales del suelo para con las plantas. En su artículo, Wolfe hace una revisión general de lo que sabemos acerca del ciclo biogeoquímico del nitrógeno y lo relaciona con las ideas actuales de respeto por el ambiente; tanto en relación con su efecto de eutrofización, como en relación con la economía energética, que repercute en el cambio climático.
No obstante su calidad como material científico, el artículo es muy accesible, de modo que cualquier estudiante de bachillerato con un regular bagaje de conocimiento biológico puede comprenderlo. Recomendamos que dicho artículo sea discutido en clase con el profesor para obtener el máximo aprendizaje posible.

Acerca del autor
David W. Wolfe es investigador en la Universidad de Cornell, en el Colegio de Agricultura y Ciencias de la Vida. Tiene un impresionante currículo como estudioso de diversas especialidades, así como escritor de artículos científicos en numerosas revistas especializadas.
Wolfe es un investigador de cambio climático y agricultura. Aunque él mismo se define como geofisiólogo. Su principal campo de interés es la fisiología ambiental vegetal (que es el estudio de la manera como las plantas funcionan y responden al estrés ambiental). Durante los últimos años ha estado muy involucrado en examinar la respuesta vegetal al incremento en el bióxido de carbono atmosférico y al cambio climático.
El grupo que comanda está particularmente bien equipado para estudios que involucren mediciones de la relación planta – agua, fotosíntesis, y dinámica de del carbono y nitrógeno en plantas y en el suelo.
Fuera del Delgado Aire
Un grupo muy especial de microbios explota el almacén más grande de nitrógeno de la atmosfera y lo convierte en disponible para el resto de los organismos.
Por David W. Wolfe

Tome una inspiración profunda. La mayor parte de lo que llena sus pulmones no es oxigeno, sino nitrógeno, en forma de gas NO2. Cada metro cubico de aire que nos rodea, en realidad esta constituido en alrededor de 80% de N2. A primera vista, esta abundancia pudiese parecer una gran bendición, pues el nitrógeno es un ingrediente esencial para la vida (un componente vital de los aminoácidos y ácidos nucleicos, las unidades básicas que forman las proteínas y nuestros genes). Sin embargo, hay una trampa. En lo que concierne a los seres vivos, da lo mismo que esta inmensa cantidad se encontrase en Marte o Júpiter. Ninguna planta, animal, hongo o protoctista ha desarrollado el arte químico de de convertir esta abundante forma gaseosa de nitrógeno en otra biológicamente útil. En realidad, si el NO2 fuese el único nitrógeno disponible, la mayoría de las especies se extinguiría (como marineros muriendo de sed en una balsa salvavidas al garete en medio del mar). Afortunadamente, dentro del oscuro y oculto campo que es el suelo bajo nuestros pies (un campo generalmente ignorado por nosotros, por encontrarse bajo la sobreestimada superficie dependiente del sol y del oxigeno), viven unas cuantas especies de bacterias que pueden metabolizar el NO2 y gracias a ello, aportar nitrógeno a la cadena alimentaria.

Los rayos y algunas bacterias que viven en las raíces de ciertas plantas, tales como el lupino comparten la rara habilidad de fijar gas nitrógeno, convirtiéndolo en una forma que tanto plantas como animales pueden aprovechar.
Los primeros microbios de la Tierra, que surgieron hace unos 3 500 millones de años, no tenían tal capacidad. El N2 estuvo disponible para ellos solo cuando se transformaba en nitratos (NO3, nitrógeno combinado con oxigeno), durante las tormentas eléctricas o la caída de meteoritos. En aquel tiempo, la energía y el calor generados por estos eventos casuales eran las únicas fuerzas de la naturaleza capaces de de aportar la energía química suficiente para separar los dos átomos de la molécula de nitrógeno.
Sin embargo, esta rociada de nitrógeno proveniente del cielo tenía algunas limitaciones inherentes con respecto al mantenimiento de la vida en la Tierra. Por una parte, el nitrato es fácilmente lavado por la lluvia y con frecuencia puede ser acarreado por las aguas torrenciales y los ríos hasta el mar, sin que ningún ser vivo pueda hacer uso de él. Por otra parte, una vez que la fotosíntesis evolucionó, (quizá hace unos 3 000 millones de años), el numero de seres vivos en la Tierra se incrementó rápidamente, creando una demanda de nitrógeno asimilable que excedió el escaso aporte.
Entró en escena un grupo único de bacterias que “inventaron” la manera de convertir o fijar el N2 gaseoso en amoniaco (el NH3 es otra forma de nitrógeno; esta vez combinado con el hidrogeno), sin necesidad del intenso calor y pandemónium asociados con los rayos y el bombardeo de meteoritos. Cuando estas bacterias morían y eran descompuestas o comidas por otros organismos, el nitrógeno que habían procesado y fijado en sus células, quedaba disponible para los demás. Esencialmente, todo el nitrógeno contenido en las proteínas y genes de plantas, animales y humanos ha sido, en un momento u otro, procesado por estos microbios fijadores de nitrógeno.
Una sola pizca de suelo de jardín puede contener unas 10 000 especies de bacterias, pero probablemente en todo el mundo no existen más de 100 a 200 especies de bacterias de vida libre fijadoras de nitrógeno. Muchas de estas son miembros de un antiguo grupo de organismos autosuficientes conocidos como cianobacterias, que pueden fijar tanto carbono (mediante la fotosíntesis) como nitrógeno. Las cianobacterias son de importancia vital como productores primarios en la base de la cadena trófica de los océanos. En tierra firme, las bacterias mas comunes e importantes son aquellas que viven como simbiontes en las raíces de las plantas, proveyendo a sus hospederos de nitrógeno y recibiendo a cambio productos de la fotosíntesis (azucares constituidos de carbono y ricos en energía).
Debido a que cerca del 99% de los organismos del suelo aun no han sido estudiados o científicamente nombrados, aun tenemos mucho por aprender acerca de los simbiontes subterráneos y del ciclo del nitrógeno. Los científicos frecuentemente descubren nuevos microbios fijadores de nitrógeno, algunos de los cuales forman asociaciones tanto con animales como con plantas. Por ejemplo, las bacterias que viven en las glándulas intestinales de un molusco barrenador de madera conocido como gusano navío, provee al animal con un tercio del nitrógeno que requiere. Y recientemente, los investigadores identificaron una espiroqueta fijadora de nitrógeno que vive en el intestino de las termitas.

Los alisos o abedules son árboles que hospedan una bacteria fijadora de nitrógeno del género Frankia, la cual nutre estos árboles y ayuda a mantener niveles saludables de nitrógeno en el suelo.
Todos los fijadores de nitrógeno del mundo, tanto simbiontes como de vida libre, dependen de las mismas enzimas (nitrogenasa) para realizar su trabajo. La nitrogenasa es un gigante entre las enzimas, tanto en el sentido literal (es una grande y compleja molécula), como figuradamente por su significancia para la bioquímica planetaria. Aquellos de nosotros que tendemos a preocuparnos por el delicado balance de la naturaleza, encontramos un poco desconcertante aprender que el suministro de nitrogenasa de todo nuestro planeta pudiera encontrarse en un solo gran rizo (Se refiere a un rizo del ADN, material genético de los seres vivos N. del T.). Si este se pierde, la vida en la Tierra, tal como la conocemos, se perdería.
Las técnicas moleculares modernas han identificado más de 20 genes bacterianos involucrados en la manufactura y control de la nitrogenasa, mientras que la cristalografía de rayos X y otras técnicas han revelado la estructura de la enzima como una larga y enrollada cadena de átomos, arreglados como espagueti, o como una bola de hilaza después de que un gato ha jugado con ella. Actualmente se sabe que la nitrogenasa se constituye de dos grandes proteínas que físicamente se separan y vuelven a reunirse ocho veces en el transcurso de 1.2 segundos mientras trabajen en el rompimiento de los enlaces entre los dos átomos de nitrógeno y convierten una molécula de N2 en dos moléculas de amoniaco. La mayoría de las reacciones químicas ocurren en millonésimas de segundo; una duración de 1.2 segundos es casi inaudita, por lo que revela lo difícil que es la fijación del nitrógeno y la cantidad de energía que debe gastarse para realizarla. Las bacterias fijadoras de nitrógeno que pueden hacer equipo con plantas o animales tienen la ventaja de emplear los azucares altamente energéticos que reciben de sus hospederos y que les ayudan a sufragar los costos de manufactura.
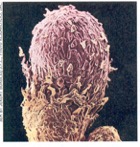
Racimos de nódulos en la raíz de la planta de soya. Las bacterias simbióticas albergadas dentro de los nódulos proveen a la planta de nitrógeno aprovechable.
Hace solo algunos siglos los biólogos descubrieron que algunas especies vegetales permiten que las bacterias fijadoras de nitrógeno invadan su sistema radicular y que el nitrógeno obtenido de esta simbiosis eventualmente queda disponible para toda la planta y para las comunidades animales. Dos oscuros científicos agrícolas alemanes, Hermann Hellriegel y Hermann Wilfarth, fueron quienes descubrieron este fenómeno cerca de 1850, cuando dirigían una serie de experimentos rutinarios en invernadero para determinar las necesidades de fertilizantes de varios cultivos. La curiosidad saco a relucir lo mejor de ellos cuando notaron que, a diferencia de otros cultivos, plantas de la familia de las leguminosas (frijoles, chicharos, alfalfa, lupino y arvejas), prosperaban aun en suelos deficientes en nitrógeno.

En un experimento definitivo, Hellriegel y Wilfarth demostraron que los chicharos plantados en suelo esterilizado desarrollaban hojas amarillentas y otros síntomas de deficiencia en nitrógeno. Esto demostró que algo que vivía en el suelo proveía a las leguminosas de nitrógeno y sugería que debía estar involucrada algún tipo de simbiosis. Unos años después, en 1888, un joven científico holandés llamado Martinus Biejerinck aisló la bacteria perteneciente al género Rhizobium que crecía dentro de pequeños nódulos visibles en la raíz de las plantas leguminosas.
Ahora sabemos bastante acerca de la manera como ocurre la fijación de nitrógeno en las leguminosas. Algo esencial para el proceso es la capacidad para discriminar de entre las decenas de miles de bacterias del suelo, solo las “adecuadas” (bacterias Rhizobium), a quienes se permite penetrar en las raíces. En el transcurso de muchos millones de años, las plantas hospederas han desarrollado mecanismos de defensa contra las infecciones bacterianas. Para superar estas defensas se requiere de alguna comunicación química compleja, orquestada por genes tanto en las plantas como en las bacterias fijadoras de nitrógeno.

La planta da el primer paso para el establecimiento de relaciones amistosas. Cuando alcanza un estado particular de desarrollo y los parámetros ambientales son los correctos, ciertos genes de la planta se activan, induciendo a las raíces a producir y exudar compuestos llamados flavonoides. Los flavonoides atraen a las bacterias rizobiales al tiempo que activan algunos de sus genes.
Una vez que el saludo químico ha ocurrido, las bacterias empiezan a producir azucares complejos y enzimas que provocan que los delgados pelos radicales de la planta se ricen y permitan la entrada de las bacterias. Es entonces cuando los rizobios se esparcen por la raíz hasta encontrar unas células hospederas especiales, en las cuales se establecen. De aquí en adelante, las bacterias y la planta (miembros de diferentes reinos), comparten el trabajo requerido para construir lo que es esencialmente un órgano nuevo: un nódulo radical totalmente funcional de fijación de nitrógeno. La planta realiza la mayor parte del trabajo, mientras que el rizobio dirige la actividad liberando secuencias de señales químicas que encienden y apagan genes de la planta. Un paso importante es la creación de una membrana semipermeable alrededor del nódulo en desarrollo; esta membrana permitirá el intercambio selectivo de amoniaco, azucares, y otros nutrientes entre las bacterias y la planta. Pronto, las bacterias inician el trabajo de fijar el nitrógeno que consiguen gracias a los espacios aéreos del suelo circundante.
Asimismo, cada tipo de bacteria fijadora de nitrógeno debe ingeniárselas para aislar a la nitrogenasa del oxigeno, debido a que la exposición al oxigeno destruye esta determinante enzima. Por ejemplo, los rizobios de una planta de chícharo inducen a la planta a fabricar leghemoglobina, una gigantesca molécula que tiene una afinidad aun mayor por el oxigeno que la hemoglobina de nuestra sangre. La leghemoglobina se une a cualquier molécula de oxigeno que entre en el nódulo proveniente de los espacios aéreos del suelo, y previene que reaccione con la nitrogenasa. (Al igual que la hemoglobina, la leghemoglobina contiene fierro y se torna intensamente roja cuando esta oxigenada. En el campo, los científicos revisan la actividad nodular abriendo uno o dos de estos y observando el color rosa a rojizo de los fluidos internos.)
Desde hace miles de años (mucho antes de que los científicos entendieran todos estos detalles), ya se reconocía la importancia de rotar el cultivo de legumbres con otras plantas. En la parte I de Los Georgianos, el poeta romano Virgilio (70 a 19 años A. C.) ya recomendaba en su oda a los trabajadores agrícolas la rotación con legumbres:
Siembra el dorado grano donde previamente
Cultivaste frijoles que alegremente vibraron
Dentro de sus vainas, o una diminuta familia de arvejas,
O las esbeltas ramas y maleza rojiza
Del amargo lupino…….
…………………………..
Así el suelo descansará en el cambio de cultivo,
Y la tierra dejada sin arar, te mostrara su gratitud.
Las legumbres continúan siendo de gran importancia en la agricultura, tanto por ser alimentos de alto contenido proteico para animales y humanos, como por su función como enriquecedoras del suelo. En la actualidad las semillas de legumbres que se venden a los agricultores son rutinariamente inoculadas con cepas de Rhizobium seleccionadas por su máxima capacidad fijadora de nitrógeno. Los arboles de leguminosas (incluidos el mezquite del desierto de Mojave, las acacias en los semi-desiertos y sabanas, así como algunas maderas tropicales duras), juegan un importante papel en el mantenimiento de los niveles de nitrógeno en los suelos de algunos ecosistemas naturales. En algunos bosques de Escandinavia, el Noroeste del Pacifico, y otras regiones templadas, las bacterias fijadoras del nitrógeno del género Frankia dominan, aportando nitrógeno mediante su asociación con los abedules, alisos, bayas, y otros especies arbóreas y arbustivas.
Así como la fijación de nitrógeno es energéticamente costosa para las bacterias, del mismo modo es costosa para la planta. Las bacterias fijadoras de nitrógeno simbiontes, frecuentemente consumen el 20% de los carbohidratos producidos por sus hospederos. Resultados preliminares obtenidos tanto por mi grupo de investigación de la Universidad de Cornell, como por otros, sugieren algunas posibilidades intrigantes para el futuro. Conforme los crecientes niveles atmosféricos de CO2 estimulan la fotosíntesis (asociados con la quema de combustibles fósiles), las legumbres serán capaces de generar más carbohidratos y de este modo mantener un mayor número de bacterias en sus raíces, posiblemente ganando de este modo una ventaja competitiva sobre otras plantas. Esto podría ser benéfico para los cultivos de leguminosas, pero del mismo modo, alteraría sin duda la composición de especies de las comunidades vegetales naturales y promovería el crecimiento de hierbas leguminosas (tales como el Kudzu del Sudoeste de los Estados Unidos y los tréboles, que competirían con los cultivos de venta inmediata y con los pastos empleados como césped).
Otra área de investigación actual se enfoca en el mecanismo que la naturaleza ha desarrollado para disminuir la fijación de nitrógeno cuando esta no es necesaria. Ahora sabemos que algunos de los genes bacterianos y vegetales que controlan la formación del nódulo y la síntesis de la nitrogenasa se apagan cuando existen en el suelo elevadas cantidades de amoniaco. Así de vital como es el mecanismo de fijación del nitrógeno, este provee solo entre 10 y 20% de los requerimientos actuales de nitrógeno para mantener la vida en la Tierra. El resto proviene del reciclamiento de nitrógeno previamente fijado. También en este caso los microorganismos juegan un importante papel.
Al principio, cuando la cadena alimentaria de nuestro planeta estaba evolucionando, un gran cantidad de criaturas del suelo, colectivamente conocidos como descomponedores, desarrollaron la capacidad de obtener su nitrógeno consumiendo microbios, plantas o animales muertos. El nitrógeno también es reciclado por un grupo de bacterias que usan los átomos de hidrogeno del amoniaco (NH3), como fuente de energía, convirtiendo durante el proceso al amoniaco en nitratos. Incluso otro grupo de bacterias, conocidas como desnitrificantes, se alimentan de los nitratos extrayendo el oxigeno que esta molécula contiene, más que como fuente de nitrógeno. Ellas emplean los átomos de oxigeno como sustituto de oxigeno puro y liberan gas de N2 como desecho de su proceso respiratorio. Así la desnitrificación regenera el N2 atmosférico y cierra el ciclo del nitrógeno.
Desafortunadamente, en la actualidad los humanos estamos interfiriendo de manera importante con este ciclo. El rápido incremento de nuestra población durante los siglos recientes ha generado la necesidad de una mayor cantidad de nitrógeno fijado. Para nutrir nuestros cultivos, inicialmente dependíamos del nitrógeno reciclado en forma de abono, pero a principios del siglo XX, los científicos alertaron que a menos de que se encontrase alguna otra fuente de nitrógeno, la escasez de alimentos era inminente. Con el surgimiento de la Primera Guerra Mundial, también hubo demanda de nitrógeno para la producción de trinitrotolueno (TNT) y otros explosivos.
Así, durante la primera década del siglo anterior, la carrera era imitar lo que los fijadores subterráneos de nitrógeno habían estado haciendo durante millones de años: generar una manera de obtener nitrógeno posible de metabolizar a partir del N2 gaseoso. A inicios del siglo XX Alemania tenía algunos de los laboratorios químicos más sofisticados del mundo. Fritz Haber, un ambicioso y dotado joven científico que trabajaba en una de estas instalaciones, fue atraído por este problema y finalmente se convirtió en el primer humano en fijar nitrógeno. O, para ser mas precisos, Haber fue el primero en lograrlo sin volar su laboratorio (y con una producción de amoniaco que hacia práctico el proceso para la producción comercial). En 1909 Haber empezó a colaborar con un ingeniero industrial llamado Carl Bosch, y para 1910 la primera fábrica de nitrógeno ya estaba en funcionamiento. La temida crisis de nitrógeno había sido salvada.

Hoy, casi un siglo después, el proceso Haber continúa siendo el único método económicamente viable para producir fertilizante sintético de nitrógeno. Desafortunadamente, el proceso requiere de grandes cantidades de energía, temperaturas de cerca de 500 °C, así como presión de varios cientos de atmosferas (varios cientos de veces la presión del aire a nivel del mar). Asi, la construcción de una planta de fertilizante nitrogenado cuesta cientos de millones de dólares. El santo grial de los químicos especializados en nitrógeno es una alternativa biotecnológica (tinas de nitrogenasa generando fertilizante barato), pero este objetivo aun no ha podido lograrse.
El Cambio de Suerte de Fritz Haber
Durante la Primera Guerra Mundial, Fritz Haber, “el hombre que fijó el nitrógeno,” fue llamado para ser la punta de lanza en un esfuerzo alemán para desarrollar armas químicas. Haber acepto, razonando que la amenaza de tales armas acortaría la guerra y daría como resultado menos sufrimiento para todos. Otros científicos se horrorizaron-cuando Haber fue premiado con el Premio Nobel de Química en 1918 por su trabajo sobre la fijación de nitrógeno, un francés que había sido llamado para ser también premiado ese año, declinó al premio en protesta, diciéndose “moralmente indispuesto en su honor.”

Mal visto e incomprendido fuera de Alemania, Haber mantuvo activo un laboratorio en su amada tierra natal hasta que los Nazis tomaron el poder en la década de 1930. Se dice que Max Plank, un físico alemán de alto rango, trato de defender a Haber y otros científicos judíos durante una conversación con Hitler. Se dice que el Fürher replicó, “Si el despido de científicos judíos significa la aniquilación de la ciencia alemana contemporánea, entonces deberemos esforzarnos sin ciencia algunos años.”
Haber huyo de Alemania en 1933. Debido a sus actividades durante la Primera Guerra Mundial, no era bienvenido en casi toda Europa. A un año de exilio, el 29 de enero de 1934, murió durante el sueño de un ataque al corazón en Basel, Suiza.


A pesar de lo costoso del proceso Haber, la demanda de fertilizante es tan grande que la cantidad de nitrógeno fijado industrialmente de este modo se ha duplicado cada seis años desde se creación. Más de 90% de las necesidades de fertilizante en los Estados Unidos son sustentadas por nitrógeno generado por la industria. La mayoría de este es empleado para generar alimentos de uso animal y no humano. Los científicos nutriólogos y agrícolas han sabido desde hace muchos años que la carne es la manera menos eficiente de cubrir nuestras necesidades dietéticas de nitrógeno (y por lo tanto de proteínas), que el consumo directo de fruta, granos y vegetales. A pesar de esto, en la mayoría de los países donde los salarios se elevan, el consumo de carne también lo hace (así como el uso ineficiente de fertilizantes nitrogenados).

Los investigadores calculan que por lo menos un tercio de la población humana se alimenta actualmente, directa o indirectamente, con ayuda del proceso Haber. Mundialmente, los humanos fijamos más nitrógeno por este método, que todos los microbios fijadores del suelo que lo hacen naturalmente. No obstante, solo entre un tercio y un medio del nitrógeno que administramos a nuestras granjas, céspedes, jardines y campos de golf anualmente, es tomado por las plantas. La mayor parte del resto, en forma de nitratos, se deposita en las aguas superficiales, estuarios y el océano. Un nivel elevado de nitrógeno en el agua potable es toxico, especialmente para los infantes. Agregado a los cuerpos naturales de agua, el nitrato estimula el desarrollo masivo de algas que atascan los cursos de agua, reducen la transparencia, y emplean tal cantidad de oxigeno que muy pocas otras especies acuáticas pueden sobrevivir en tal ambiente. El nitrato proveniente de granjas y fabricas en la parte central de US drena cotidianamente a través del rio Mississippi hasta el Golfo de México; en ciertos años, esto crea una “zona de la muerte” de varios miles de kilómetros cuadrados.

La fuga de nitrógeno no utilizado por las plantas de las granjas, césped y campos de golf pueden estimular brotes masivos de algas y hacer que cuerpos de agua prístinos se conviertan en estanques sucios y verdosos carentes de peces.
Recientemente, los científicos descubrieron que las concentraciones atmosféricas de oxido de nitrógeno (N2O), un producto del proceso de des nitrificación microbiano, se ha incrementado de 290 a 310 partes por billón en los pasados 50 años, de forma paralela al incremento en el suelo debido a la acción humana. Aun en cantidades traza, el oxido de nitrógeno puede provocar lluvia acida, contribuir al deterioro de la capa de ozono que nos protege de la radiación ultravioleta, y actúa como un potente gas de invernadero (300 veces más potente que el bióxido de carbono).
En respuesta a la opinión pública en cuanto a la protección del ambiente, muchos granjeros han empezado a trabajar con científicos agrícolas para establecer tanto la precisión en cuanto a la aplicación del fertilizante nitrogenado como la eficiencia con que los cultivos vegetales asimilan el nitrógeno. Algunos granjeros están adoptando métodos de “alimentar a cucharadas”, ya que fertilizan lentamente sus cultivos conforme estos se desarrollan, en lugar de administrar grandes cantidades al suelo justo después de sembrar. Una tecnología nueva que actualmente se esta probando en algunas áreas, es el empleo de posicionamiento global vía satélite (GPS) para crear mapas de alta resolución acerca de los nutrientes en los suelos agrícolas. Conforme un granjero pasa por sus cultivos en un tractor, la información del GPS es cargada en la computadora del tractor, y se aplica la cantidad correcta de fertilizante, ajustándose metro a metro. Otras investigaciones se enfocan en la carga genética de las legumbres y sus socios bacterianos fijadores de nitrógeno. El empleo de legumbres como cultivos de rotación nuevamente esta ganando preferencias. Y algunos granjeros incluyen “trampas de cultivo” en sus rotaciones (plantas tales como el centeno y el pasto de Sudán, que tienen sistemas radicales abundantes y profundos que son capaces de absorber el nitrato antes de que drene hacia las aguas superficiales). Finalmente, los investigadores en genética esperan reducir los requerimientos de nitrógeno de algunos de los cultivos alimenticios mas importantes del planeta. Mi propio programa de investigación incluye un proyecto colaborativo con la genetista Margaret Smith, también de la Universidad de Cornell, para desarrollar variedades de maíz que empleen el nitrógeno de manera mas eficiente.

¿Puede la ingenio humano, que llevó a un proceso de fijación de nitrógeno ayudarnos a encontrar soluciones a los problemas que hemos creado por estropear el ciclo del nitrógeno? Sabemos que nuestras actividades fijadoras de nitrógeno del siglo pasado han incrementado significativamente la capacidad de la Tierra para mantener la vida, pero también sabemos que si queremos mantener la vida, así como proteger nuestro ambiente natural, necesitaremos desarrollar maneras mejores y más eficientes para manejar el nitrógeno que fijamos.
Tomado de Wolfe, W. D. “Out of Thin Air”. Natural History. Vol. 110, No. 7. September, 2001. Pp 44-53. Traducción libre por: M. en C. Luis Alfredo Vázquez Bárcena
